Trích:
Nguyên văn bởi trungkien912
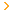
Cho HN3(aq) + H+(aq) = NH4+(aq) delta Ho = -51,97kJ
Bằng thực nghiệm xác định được rằng ở 25 độC,
khi [NH4+] = [NH3] có [H+]= 5,56.10^-10M
1. xác định delta So của phản ứng trên.
2. tính Kb của NH3(aq) ở 25 độ C.
3. cần phải thêm bao nhiêu mol Hcl vào 1l dung dịch có [NH4+]=[NH3+]=0,1M để pH của dung dịch đó thay đổi 0,1 đơn vị? có thể coi dung dịc không thay đổi khi thêm Hcl.
|
1. Xét phản ứng:
NH3 + H+ = NH4+----------Kpư
Khi [NH4+] = [NH3] có [H+]= 5,56.10^-10M, ta có:
Kpư = [NH4+]/([H+].[NH3]) = 1,8.10^9
=> Delta Go = -RTlnK = -8,314.298.ln(1,8.10^9) = - 52800 = -52,8kJ
=>
Delta So = (Delta Ho - Delta Go)/T = 2,78 J/độ
2. Hằng số bazơ của NH3 chính là hằng số của cân bằng:
NH3 + H2O <=> NH4+ + OH-----------------Kb
Từ đó dễ dàng xác định được
Kb = Kpư.Kw = 1,8.10^-5.
3. Ta đã biết, khi [NH4+]=[NH3+] thì [H+]= 5,56.10^-10M <=> pH = 9,25
Khi thêm HCl thì pH sẽ giảm => Theo đề ra ta có pH sau khi thêm HCl sẽ là 9,25 - 0,1 = 9,15.
Mặt khác ta có, pH của dung dịch gồm NH3, NH4+ (dung dịch đệm) được tính theo công thức:
pH = pKa + lg[(NH3)/C(NH4+)] => 9,15 = 9,25 + lg [(0,1 - x)/(0,1+x)]
(với x là số mol HCl cần cho vào 1 lít...)
=> x = 0.0822mol
Chú ý: Có thể tính số mol HCl dựa vào đệm năng.



